BMJ Public Health | 对抗癌新药的乐观与谨慎:全球视角下药品公平与安全的两难局面
- 来源:未知
- 作者:bmjchina
- 日期:2025-04-28
- 分享:
先导语:
谁能更快用上安全救命的新药?在抗癌“生命线”上有一道少为人知的隐形关卡。
当生命与癌症竞赛时,时间往往决定生死。然而,当免疫检查点抑制剂(ICIs)为全球癌症患者带来曙光时,这道光并未均匀洒落在每个人身上——不同国家的患者获得它的数量和速度存在巨大的差异。这背后不仅是监管机构对药物疗效和安全的审慎考量,更折射出各国医疗体系关注点的不同,以及全球医疗资源分配的不均衡。
审批更快,意味着患者能更早获益,但也意味着潜在的风险,因为部分药物可能在上市后因发现效果不佳和/或副作用太大而被退市。审批慢一点、谨慎一些,有助于积累更充分的证据,确保药物的效果和安全,但即使短短几个月的等待,也会使很多癌症患者错失宝贵的治疗机会。当药物审批的“乐观”与“谨慎”成为天平两端时,我们能否找到既快速又安全的第三条路?
为试图揭示这“乐观”与“谨慎”两难局面背后的真相,一项最新研究对比了美国、欧盟和中国大陆在ICIs审批上的差异,或将为打开第三条路提供密码,使药物的审批既不因过度谨慎而延误了治疗,也不因盲目加速而伤害了病人。
针对效率与安全如何兼顾的监管问题,中国药品监管部门近年出台深化药品审评审批制度改革措施,大力发展药品监管科学,以期在加快创新药上市审批的同时,更好满足公众对安全有效药品的需求。
主要发现:
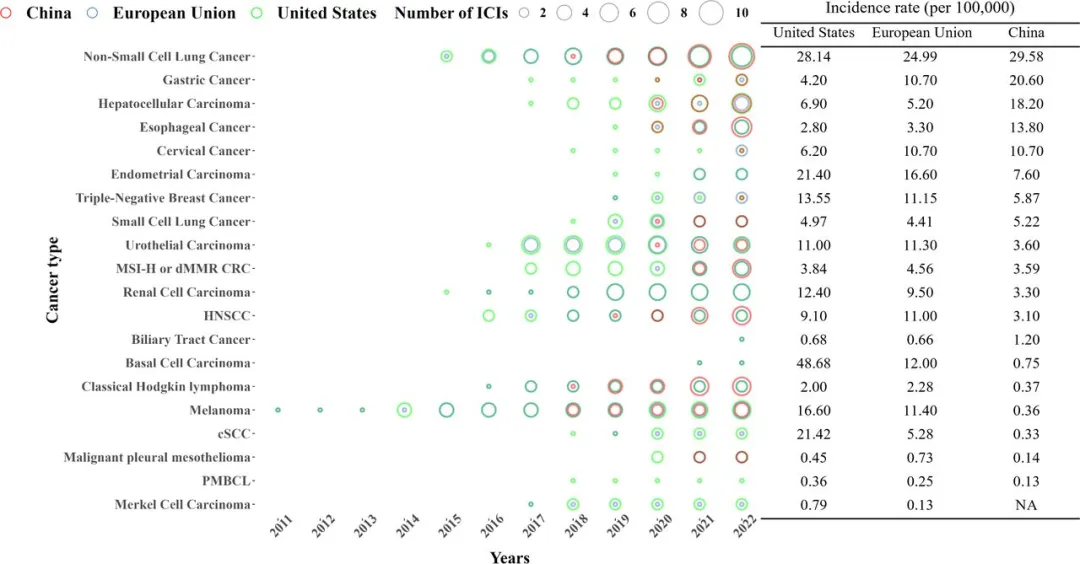
该研究发表于BMJ Public Health期刊,首次深入分析了美国、欧盟和中国大陆在ICIs审批过程中的关键差异,其中包括适应证、审评时间和临床试验证据等方面。
研究发现,与美国相比,欧盟和中国大陆对ICIs适应证的批准时间较晚,审评周期更长,但对确证性临床证据的要求也更为严格。此外,不同地区在ICIs的适应证数量、剂量、适用人群以及证据基础等方面存在较大差异。上述这些地区差异可能对全球癌症治疗的公平性、可及性和证据的充分性影响深远。
原文献信息:
Disparities in the access to immune checkpoint inhibitors approved in the United States, the European Union and mainland China: a serial cross-sectional study
Jia-Xin Cai, Shi-Yu Wang, Hao Hu et al.
BMJ Public Health 2025;3:e001995.
doi: 10.1136/bmjph-2024-001995
作者简介 该研究由深圳理工大学循证医学与人工智能中心唐金陵、杨智荣团队和诺丁汉大学卓越灯塔计划(宁波)创新研究院孟伟华团队联合开展。宁波诺丁汉大学与深圳理工大学联合培养博士生蔡佳歆和中国科学院深圳先进技术研究院科研助理王诗语为论文共同第一作者,诺丁汉大学卓越灯塔计划(宁波)创新研究院孟伟华副教授和深圳理工大学循证医学与人工智能中心杨智荣助理教授为论文共同通讯作者。唐金陵和杨智荣团队与孟伟华团队在生物医药和医学大数据分析等领域长期合作,专注于探索药物的临床应用模式和监管策略,以改善全球肿瘤等重大疾病的治疗现状。国家药品监督管理局药品评价中心的宋海波研究员以及澳门大学药品监管科学中心的胡豪教授、吴蔼琳助理教授对本研究做出了重要贡献。 关于BMJ Public Health BMJ Public Health是一本经同行评议的开放获取期刊,涵盖公共卫生的各个方面,包括从气候变化对人口健康的影响等全球性问题到在特定国家/地区进行的研究。 收稿率:21% 出版频率:连续出版 出版速度: 投稿至初步决定:137天(中位时间;含外审) 接收至发表:30天(中位时间) 创刊年份:2023年





 京公网安备 11010502034496号
京公网安备 11010502034496号